Behandlung von Risikopatienten
Nachfolgend werden die Optionen zur Behandlung von Patienten mit Indikatoren für ein hohes Risiko oder eine vorhandene arteriosklerotische kardiovaskuläre Erkrankung (ASCVD), eine chronische Nierenerkrankung (CKD) oder eine Herzinsuffizienz (HI) erläutert.Bei einer überwiegend arteriosklerotischen kardiovaskulären Erkrankung
Liegt bei Patienten eine nachgewiesene ASCVD vor oder bestehen Indikatoren für ein hohes ASCVD Risiko sollte vorzugsweise eine Behandlung mit GLP-1 Rezeptoragonisten (GLP-1RA) mit einem erwiesenen kardiovaskulären Vorteil oder SGLT-2 Inhibitor (SGLT-2I) mit nachgewiesenem kardiovaskulären Vorteil sofern die eGFR adäquat ist, eingesetzt werden. Ein hohes Risiko liegt vor bei einem Alter >55 und zwei oder mehr zusätzlichen Risikofaktoren. Liegt mit einer Monotherapie der HbA1c über dem persönlich vereinbarten Ziel wird eine Kombinationstherapie von GLP-1R und SGLT2I empfohlen. Sollte sich auch damit die Einstellung nicht erreichen lassen, wird nicht empfohlen sofort zum Insulin zu greifen sondern es soll versucht werden herauszufinden welche Barrieren die Erreichung des Ziels verhindern. Eine erneute Schulung sollte erwogen werden, eine CGM sollte erwogen werden, um therapeutischen Lücken zu erkennen und vor allem sollten auch soziale Einflussfaktoren berücksichtigt werden. Die Insulintherapie ist somit die letzte Maßnahme, wenn sich mit anderen Mitteln die Ziele nicht erreichen lassen.Liegt eine Herzinsuffizienz mit einer verminderten Auswurfrate (HFerEF) oder erhaltener Auswurfrate sollte mit einem SGLT-2I behandelt werden.
Eine chronische Nierenerkrankung mit einer eGFR < 60 ml/min pro 1,73 m² Körperoberfläche oder einer Albuminurie muss zuerst mit der maximal tolerierten Dosis eines ACE-Hemmers oder eines Angiotensin Rezeptorblocker behandelt werden. Die weitere Therapie bei Patienten mit Diabetes mellitus Typ 2 und einer chronischen Nierenerkrankung ist dann die zusätzliche Behandlung mit einem SGLT-2I. Bei Kontraindikationen gegen SGLT-2I, bei Unverträglichkeit oder wenn die glomeruläre Inflationsrate nicht ausreichend ist, kann die Behandlung mit einem GLP-1RA durchgeführt werden. Wenn das HbA1c Ziel nicht erreicht wird, können SGLT-2I und GLP-1RA kombiniert werden.
Durch Klicken auf die Grafik kann das Bild vergrößert werden:
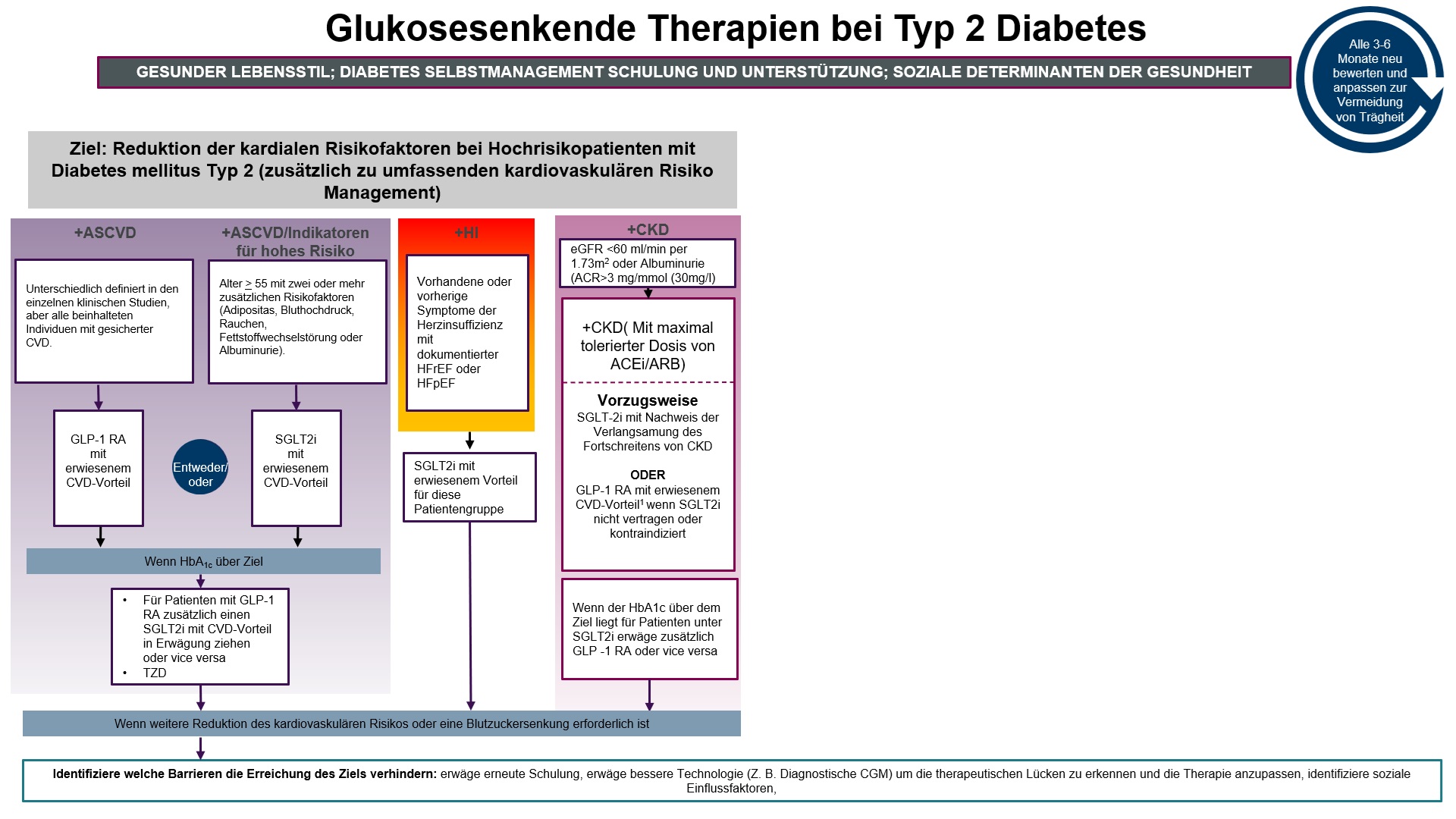
Modifiziert nach: 9. Pharmacologic Therapy for Adults With Type 2 Diabetes: Standards of Care in Diabetes-2024 Diabetes Care 2024; 47 (Suppl. 1): Fig.:9.3, S167
Erklärung der Abkürzungen: ASCVD, atheroskeloritsche kardiovaskuläre Erkrankung; CKD, chronische Nierenerkrankung; CV, kardiovaskulär; CVOT, kardiovaskuläre Endpunkt-Studien; DPP-4i, Dipeptidylpeptidase-4-Inhibitor; eGFR, geschätzte glomeruläre Filtrationsrate; GLP-1 RA, Glukagon-like-Peptide-1-Rezeptoragonist; HI, Herzinsuffizienz; SGLT-2i, Natrium-Glukose-Contransporter-2-Inhibitor; SH, Sulfonylharnstoff; TZD, Thiazolidindion, HFrEF Auswurffraktion bei Herzinsuffizienz; LVH Hypertrophie der linken Herzkammer.
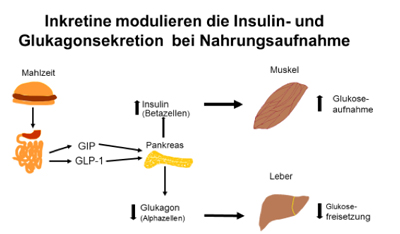
Zum Verständnis der Wirkungsweise der GLP-1RA ist die Kenntnis des Inkretineffektes Voraussetzung.
Was sind Inkretine und wie wirken sie?
Schon lange ist bekannt, dass der Blutzuckerspiegel durch Darmhormone reguliert wird: die Inkretine GLP-1 (Glucagon-like-Peptid-1) und GIP (Glucose-dependent insulinotropic peptide). Nach einer Mahlzeit werden GLP-1 und GIP in der Schleimhaut (Mukosa ) im Darm freigesetzt. Die Inkretine aktivieren das autonome Nervensystem in der Darmschleimhaut. Von dort geht das Signal über eine Region im Gehirn, dem Hypothalamus, an die Zielorgane. Die Zieleorgane sind die Alpha- und Betazellen im Pankreas, die Leber und der Magen. Dort entfalten sie in Abhängigkeit vom aktuellen Blutzucker folgende Wirkungen:- Inkretine regen die Betazellen der Bauchspeicheldrüse (Pankreas) an, Insulin auszuschütten.
- Inkretine hemmen die Glukagon-Bildung in den Alphazellen des Pankreas (Glukagon setzt Glukose aus der Leber frei).
- Inkretine verzögern die Magenentleerung, wodurch ein längeres Sättigungsgefühl entsteht, welches zu weniger Nahrungsaufnahme führt.
Wie wirken Inkretine auf den Blutzucker?
Die Inkretine sind für 60 bis 70% der gesamtem Insulinausschüttung nach dem Essen verantwortlich (Inkretineffekt). Als Folge der Inkretinwirkungen sinkt der Blutzucker. Die Wirkung der Inkretine wird begrenzt durch das Enzym Dipeptidyl-Peptidase-4 (DPP-4), das GIP und GLP-1 in wenigen Minuten abbaut.GLP-1 ist ein Peptid aus 30 Aminosäuren (Peptid = organische Verbindung aus Aminosäuren)

Wie wirken Inkretin-Verstärker bei Typ 2 Diabetes?
Der Inkretineffekt ist bei Menschen mit Typ-2-Diabetes vermindert, die Blutzuckerregulierung nach der Nahrungsaufnahme dadurch erschwert:- Nach Nahrungsaufnahme wird bei Menschen mit Diabetes mellitus Typ 2 weniger Insulin aus den Betazellen freigesetzt, da zu wenig GLP-1 aus den Zellen der Darmschleimhaut zur Verfügung steht.
- Nach der Nahrungsaufnahme wird die Freisetzung von Glucagon aus den Alphazellen nicht unterdrückt. Glukagon erhöht die Blutzuckerspiegel durch die Freisetzung von Glukose aus der Leber. Beim Gesunden wird nach Nahrungsaufnahme die Freisetzung von Glucagon ausreichend unterdrückt.
- Bei Menschen mit Diabetes mellitus Typ 2 wird die Magenentleerung durch den fehlenden Inkretineffekt nicht ausreichend verzögert.
GLP-1 Rezeptor Agonisten bei Typ-2-Diabetes
Bei den GLP-1 Agonisten (GLP-1 Rezeptor Agonisten, Stoffe die wie GLP-1 auf den Rezeptor wirken) handelt es sich um kleine Peptide. Da Peptide im Magen verdaut werden, müssen sie wie Insulin ins Unterhautfettgewebe gespritzt werden. Für ein Präparat konnte eine Formulierung gefunden werden, sodass es auch als Tablette verabreicht werden kann (Semaglutid oral (Rybelsus®) Bei diesen GLP-1R wurden am Angriffspunkt des Enzyms DPP-4 die Aminosäuren ausgetauscht, sodass die Peptide nicht mehr gespalten werden können. Weiterhin wurde die Aminosäuresequenz geändert, um die Wirkdauer zu verlängern. GLP-1R werden in kurzwirksame und langwirksame unterteilt.Kurzwirksame mit täglicher Verabreichung sind:
- Exenatid (Byetta®, zweimal täglich)
- Liraglutid (Victoza®, Saxenda®)
- Lixisnatid (Lyxumia®)
- Semaglutid oral (Rybelsus®)
- Bydureon® – die Moleküle werden in ein resorbierbares Material verpackt. Dadurch lässt sich eine Wirkdauer von einer Woche erreichen)
- Dulaglutid (Trulicity®) – bei Trulicity® wurde außer der Veränderung der Aminosäuresequenz noch eine Fettsäurekette angefügt, sodass sich ebenfalls eine Wirkdauer von einer Woche ergeben hat.
- Semaglutid subkutan (Ozempic®, Wegovy®)
- IDegLira (Xultophy®)
- IGlarLixi (Suliqua®)
Die Hauptnebenwirkung der GLP-1 Analoga ist Übelkeit. Die Übelkeit nimmt im Lauf der Zeit ab. Bei einigen Patienten sind die Beschwerden jedoch so stark, dass die Therapie abgebrochen werden muss. Bei Bydureon® können an den Einstichstellen Rötungen entstehen, die auch jucken.
Entsprechend den Leitlinien soll bei Patienten mit einer nachgewiesenen arteriosklerotischen kardiovaskulären Erkrankung oder mit Indikatoren für ein hohes Risiko für eine arteriosklerotische kardiovaskuläre Erkrankung eine Behandlung mit GLP-1 RA zusätzlich zu Metformin begonnen werden. Patienten älter als 55 und mit Stenosen an den Herzkranzarterien, an denen Arterien des Halses (Carotiden) oder den Beinarterien gehören zu den Patienten mit erhöhtem Risiko.
Es sollen jedoch nur GLP-1 RA mit erwiesenem kardiovaskulärem Vorteil eingesetzt werden.
GLP-1-RA: Studien zeigen Wirksamkeit und Sicherheit
Auf dem Kongress der amerikanischen Diabetesgesellschaft ADA 2016 in New Orleans wurden die erste Endpunktstudie zur kardiovaskulären Sicherheit von dem GLP-1 Analogon Liraglutid (Victoza®) vorgestellt. Die amerikanische Arzneimittelbehörde FDA verlangt diese Studien, um sicherzustellen, dass die Medikamente kein erhöhtes Risiko für einen Herzinfarkt, Schlaganfall oder Tod jeglicher Ursache darstellen. Die Diabetesmedikamente sind entwickelt worden, um den Blutzucker zu senken. Eine Senkung des Blutzuckers verringert möglicherweise das Risiko für kardiovaskuläre Ereignisse oder Tod. Daher werden diese Medikamente immer doppel-blind (Arzt und Patient wissen nicht, ob mit Placebo oder Medikament behandelt wird) gegen Placebo getestet. Beide Gruppen erhalten jedoch eine Standardtherapie mit anderen Diabetesmedikamenten und Insulin. Die Einstellung beider Gruppen muss gleich sein, damit das mögliche kardiovaskuläre Risiko nicht durch eine Verbesserung der Blutzuckereinstellung verschleiert wird. Da die Blutzuckersenkung in beiden Gruppen gleich sein muss, kann durch die neuen Medikamente kein positiver Effekt erwartet werden und es wird bezüglich des kardiovaskulären Risikos nur auf Nicht- Unterlegenheit getestet. Die Gruppen müssen auch bezüglich aller anderen Faktoren, die das Risiko beeinflussen können, gleich sein. Dazu gehören das Alter, das Gewicht, die Blutdruckeinstellung, die Behandlung mit Statinen, Thrombozytenaggregationshemmern etc.Die Studie wurde international durchgeführt und in jede Gruppe wurden über 4600 Patienten eingeschlossen. Trotz des vermehrten Einsatzes von Insulin, ist es in der Placebogruppe nicht gelungen eine so gute Einstellung wie mit Liraglutid zu erreichen. Nach der durchschnittlichen Beobachtungsdauer von 36 Monaten war der HbA1c in der Liraglutid-Gruppe immer noch 0.4% besser als in der Placebogruppe. Der systolische Blutdruck war um 1,2 mmHg besser und die Patienten hatten durch Liraglutid 2,3 kg abgenommen. Die Behandlung mit Liraglutid hatte keinen Einfluss auf das LDL-Cholesterin oder das HDL-Cholesterin.
Der primäre Endpunkt bestand aus nicht-tödlichem Herzinfarkt, nicht-tödlichem Schlaganfall oder vaskulärer Tod. Überraschenderweise verminderte Liraglutid das Risiko diesen Endpunkt zu erreichen um 13 %. Auch der Tod jeglicher Ursache wurde durch Liraglutid um 15 % verringert. Die Patienten mit Liraglutid hatten weniger Augenprobleme und es kam weniger zu einer Verschlechterung der diabetischen Nierenerkrankung.
Damit hatten wir nach Empagliflozin ein weiteres Medikament zur Diabetesbehandlung zur Verfügung, das den Blutzucker, das Gewicht und den Blutdruck senkt und auch noch das Risiko zu versterben signifikant mindert (ADA2016 New Orleans).
Inzwischen wurden auch für die GLP-1 RA Dulaglutid und Semaglutid entsprechende Studien durchgeführt. Die wöchentliche Anwendung ist bei den Patienten sehr beliebt und völlig unkompliziert durchzuführen. Die Studienergebnisse zeigen insbesondere für Semaglutid eine deutlich bessere Wirkung bezüglich HbA1c-Senkung, Gewichtsabnahme, kardiovaskulärer Tod, Herzinfarkt und Schlaganfall.
GIP und GLP-1 Rezeptoragonisten
Tirzepatid (Mounjaro®), der kombinierte GIP und GLP-1 Rezeptoragonist Tirzepatid ist ein Analog von GIP. GIP ist ein gastrointestinales Hormon das ebenfalls wie GLP-1 freigesetzt wird (siehe Abbildung oben). Tirzepatid wirkt auf den GLP-1 und GIP Rezeptor. Tirzepatid senkt stärker den Blutzucker und vor allem das Gewicht. Es wird wie die GLP-1 Rezeptoragonisten einmal die Woche subkutan verabreicht. Adipöse Patienten (BMI > 30) hatten nach 72 Wochen 15 % ihres Ausgangsgewichts mit der 5 mg Dosis verloren und 20 % mit der 10 mg Dosis. Die Nebenwirkungen entsprechen den anderen GLP-1 Rezeptoragonisten. Für Patienten mit familiärem medullären Schilddrüsenkarzinom oder von Patienten mit MEN2 ist Tirzepatid kontraindiziert. Außer GLP-1 RA besteht auch die Möglichkeit bei Patienten mit nachgewiesenen arteriosklerotischen kardiovaskulären Erkrankung oder mit Indikatoren für ein hohes Risiko für eine arteriosklerotische kardiovaskuläre Erkrankung SGLT-2 Inhibitoren einzusetzen.
Zucker über die Niere ausscheiden: SGLT2-Inhibitoren
Der Diabetes mellitus war bereits im Altertum bekannt. Die Diagnose wurde gestellt durch Kosten des süßen Urins. Über die Niere wird bei Blutzuckerwerten über 180 mg/dl (10 mmol/l) der Zucker über den Urin ausgeschieden. Bereits Anfang des 19. Jahrhunderts konnte aus der Rinde von Apfelbäumen eine Substanz (Phlorizin) isoliert werden, die einen erhöhten Urinzucker verursachte. Die Aufklärung des Glukosestoffwechsels in der Niere führte zur Entwicklung von neuen oralen Antidiabetika, den SGLT-2 (Sodium-glucose linked transporter) Inhibitoren. Der Glukosestoffwechsel in der Niere ist in folgender Abbildung dargestellt.
In der Niere befinden sich viele kleine Nierenkörperchen (Glomeruli), die die festen Bestandteile des Blutes zurückhalten und den Primärharn absondern. Ein Glomerulus besteht aus einem Gefäßknäuel, das in eine Membran eingebettet sind, aus dem der Primärharn überein Röhrchen, den sogenannten Tubulus, abgeleitet wird. Der Tubulus wird eingeteilt in einen proxymalen (nahe am Glomerulus gelegen) und einen distalen (weiter weg vom Glomerulus). In den Glomeruli wird die Glukose komplett abfiltriert. Damit sie nicht über den Urin vollständig ausgeschieden wird, muss sie über aktive Transportsysteme wieder aus dem Primärharn aufgenommen werden. Diese Transportsysteme befinden sich im proxymalen Tubulus. 90 % der Glukose wird durch den SGLT-2 Transporter und 10 % durch den vom Glomerulus etwas entfernteren SGLT-1 Transporter wieder aufgenommen. Durch diese beiden Transporter wird die Glukose komplett wieder aufgenommen und beim Gesunden wird keine Glukose über den Urin ausgeschieden. Ist die Konzentration der Glukose im Blut zu hoch, ist auch die Konzentration der Glukose im Primärharn erhöht. Bei ungefähr 180 mg/dl (10 mmol/l) Blutzucker sind die Transportsysteme in der Niere erschöpft und sie können nicht mehr die komplette Glukose wieder aufnehmen. Die Glukose wird dann über den Urin ausgeschieden. Wird Glukose im Urin festgestellt, ist der Patient mit Diabetes mellitus schlecht eingestellt, da seine Blutzuckerwerte über 180 mg/dl (10 mmol/l) sind.
So senken SGLT2-Inhibitoren den Blutzucker
Man kann den Nierenstoffwechsel auch dazu verwenden die Blutzuckereinstellung zu verbessern. Hemmt man die Glukosetransporter, werden bis zu 70 g Glukose pro Tag über den Urin ausgeschieden. Dadurch sinken die Blutzuckerspiegel. Mit SGLT-2 Inhibitoren lässt sich der HbA1c gegenüber Placebo um ungefähr 0,7 % senken. Die ausgeschiedene Glukose bedeutet, dass der Patient ungefähr 280 kcal am Tag verliert. Durch diesen Energieverlust nehmen die Patienten ungefähr 2 kg ab. Dabei erzielt man mit der Therapie einen anhaltenden Gewichtseffekt und in langen Studien konnte gezeigt werden, dass nach vier Jahren die Patienten in einer Kombinationstherapie mit Metformin durchschnittlich 4,4 kg weniger wogen, als die Vergleichsgruppe mit Metformin und einem Sulfonylharnstoff. Durch die SGLT-2- Inhibitoren kommt es auch zu einer leicht erhöhten Urinausscheidung und der systolische Blutdruck wird im Durchschnitt um 4,4 mmHg und der Diastolische um ungefähr 1,6 mmHg gesenkt. Der SGLT-2 Transporter kommt ausschließlich in der Niere vor, der SGLT-1 Transporter findet sich vor allem noch im Darm und sorgt für die Aufnahme der Glukose über die Darmschleimhaut.Was Sie zu SGLT2-Inhibitoren wissen sollten
Man kann den Nierenstoffwechsel auch dazu verwenden die Blutzuckereinstellung zu verbessern. Hemmt man die Glukosetransporter, werden bis zu 70 g Glukose pro Tag über den Urin ausgeschieden. Dadurch sinken die Blutzuckerspiegel. Mit SGLT-2 Inhibitoren lässt sich der HbA1c gegenüber Placebo um ungefähr 0,7 % senken. Die ausgeschiedene Glukose bedeutet, dass der Patient ungefähr 280 kcal am Tag verliert. Durch diesen Energieverlust nehmen die Patienten ungefähr 2 kg ab. Dabei erzielt man mit der Therapie einen anhaltenden Gewichtseffekt und in langen Studien konnte gezeigt werden, dass nach vier Jahren die Patienten in einer Kombinationstherapie mit Metformin durchschnittlich 4,4 kg weniger wogen, als die Vergleichsgruppe mit Metformin und einem Sulfonylharnstoff. Durch die SGLT-2- Inhibitoren kommt es auch zu einer leicht erhöhten Urinausscheidung und der systolische Blutdruck wird im Durchschnitt um 4,4 mmHg und der Diastolische um ungefähr 1,6 mmHg gesenkt. Der SGLT-2 Transporter kommt ausschließlich in der Niere vor, der SGLT-1 Transporter findet sich vor allem noch im Darm und sorgt für die Aufnahme der Glukose über die Darmschleimhaut.Überwiegend Herzinsuffizienz oder chronische Nierenerkrankung
Herzinsuffizienz Die Endpunktstudien für Dapagliflozin und Empagliflozin ergaben eine deutlich reduzierte Sterblichkeit bei Patienten mit Herzinsuffizienz. Die Wirkung der SGLT-2 Inhibitoren ist nicht nur auf Patienten mit Diabetes mellitus beschränkt. In Studien konnte eine deutliche Verbesserung der Überlebensrate von Patienten mit Herzinsuffizienz nachgewiesen werden, die keinen Diabetes mellitus haben. Die SGLT-2 Inhibitoren sind damit fester Bestandteil der Therapie der Herzinsuffizienz geworden, unabhängig vom Vorhandensein eines Diabetes mellitus. Die SGLT2 Inhibitoren werden zunehmend von den Kardiologen verordnet.
Chronische Nierenerkrankung
Bei Patienten mit Diabetes mellitus sind die Blutzuckerwerte erhöht und es fließt mehr Glukose durch das Glomerulum der Niere. Patienten mit Diabetes mellitus haben eine erhöhte glomeruläre Filtrationsrate. Dies bedeutet, es wird im Glomerulum der Niere mehr Flüssigkeit und Glukose filtriert, der im proximalen Tubulus erscheint. Im proximalen Tubulus befindet sich der SGLT-2 Transporter, der Na+ (Natrium, die Verbindung von Na+ und Chlor– ist Kochsalz) und Glukose aufnimmt. Durch den erhöhten Anfall von Glukose im proximalen Tubulus wird dieser Transporter aktiviert und er nimmt mehr Glukose und Na+ auf. Die Folge ist, dass dadurch weniger Na+ sich im weiterführenden System der Tubuli befindet. Die Tubuli werden zurückgeführt zum Glomerulum und haben dort Kontakt mit der sogenannten Macula densa. Wenn zu wenig Na+ an der Macula densa ankommt werden Hormone freigesetzt, die zu einer Erweiterung der zuführenden Gefäße des Glomerulums führen. Da die abführenden Gefäße nicht erweitert sind, wird dadurch der Druck im Glomerulum erhöht. Ein erhöhter Druck schädigt das Glomerulum und führt langfristig zu einer diabetischen Nephropathie. Die SGLT-2 Inhibitoren hemmen den Na+/Glukose Transporter im proximalen Tubulus der Niere. Dadurch wird die Zufuhr von Na+ zur Macula densa wieder erhöht und die zuführenden Arteriolen zum Glomerulum werden nicht erweitert. Der Druck im Glomerulum normalisiert sich und eine Schädigung der Niere wird verhindert. Über diesen Mechanismus schützen die SGLT-2 Inhibitoren die Niere und die Endpunktstudien haben gezeigt, dass sich die chronische Niereninsuffizienz durch die Behandlung mit SGLT-2 Inhibitoren bei Patienten mit Diabetes mellitus nicht weiter verschlechtert. Vorzugsweise werden bei einer chronischen Niereninsuffizienz SGLT-2 Inhibitoren empfohlen.
Werden SGLT-2 Inhibitoren nicht vertragen oder besteht eine Kontraindikation oder die eGFR ist nicht mehr ausreichend, sollten an ihrer Stelle GLP-1 RA eingesetzt werden.
Liegt der HbA1c über dem individuell festgelegten Therapieziel kann auch hier eine Kombination von GLP-1 RA und SGLT-2 Inhibitoren eingesetzt werden.
Kategorisiert in: Therapie Typ 2
Dieser Artikel wurde verfasst von Prof. Dr. Klaus Kusterer












